土壤有机碳绝大部分来自光合碳的输入与转化,光合碳通过根系周转与根系分泌物等进入土壤碳库。植物残体和凋落物经过复杂的分解过程后形成土壤有机碳组分,秸秆还田与有机肥施用也是稻田土壤有机碳的重要来源,由于这两部分的来源较为直接,目前已有较多研究,认识也较清楚。而来源于根系分泌物及其脱落物的根际沉积碳,由于其代谢周转快,具有复杂性和多变性,尽管已有一些研究,但还不十分清楚这部分碳的命运(图1)。另外,微生物可以通过多条固碳途径进行CO2同化,其中,卡尔文循环是光能自养生物与化能自养生物同化CO2的主要途径,在调节大气CO2浓度发挥着重要的作用。而且,土壤中也存在相当数量的光能自养生物与化能自养生物。因此,稻田土壤微生物是否也存在其他固碳途径,其对稻田碳循环的贡献如何,更是缺乏系统的认识,处于灰箱状态(图1)。
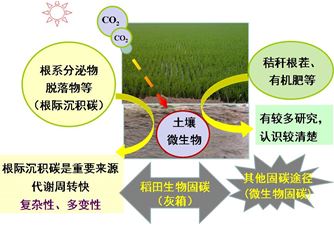
图1 稻田土壤有机碳来源
基于此,近几年来,中科院亚热带农业生态研究所农业生态过程方向研究团队、长沙农业环境观测研究站,在国家自然科学基金、中国科学院战略性先导科技专项、中国科学院、国家外国专家局创新团队国际合作伙伴计划等的资助下,整合14C同位素标记技术和微生物分子生态学技术(克隆文库、T-RFLP及定量PCR),结合室内培养实验与稻田长期定位试验,聚焦于典型稻田生态系统的生物固碳过程与机制,从水稻光合碳的输入、转化(图2)及其土壤微生物固碳功能及其生物学机制(图3)两方面开展工作,取得了一系列重要进展。
应用14CO2连续示踪技术,从光合碳的输入与转化,不同养分条件对光合碳传输的影响以及光合碳的分解动态三方面来揭示光合碳向土壤碳库的输入与转化调节机制(图2)。结果表明,在水稻拔节灌浆期内,通过水稻的根际沉积作用,有4-6%的光合碳进入土壤有机碳库,这部分新碳对土壤可溶性有机碳的贡献为2-4%,对土壤微生物生物量碳的贡献为9-18%。同时,水稻光合碳的输入抑制了稻田土壤原有有机碳的矿化分解,表现出明显的负激发效应,这对维持稻田土壤的碳汇功能具有十分重要的作用,研究结果发表在Soil Biology & Biochemistry(Ge et al., 2012, 48: 39–49)。而且,不同施氮水平亦对水稻光合碳输入及其在不同碳库中分配产生影响,结果表明,在较高的施N水平下,水稻地上部对碳的积累能力相对较强,水稻光合碳通过根际沉积作用输入到土壤中的14C-SOC的含量亦相对较高,施N水平明显促进了水稻新鲜根际碳的沉积,且高氮水平下根际沉积的碳量高于低氮与中量氮水平。同时,水稻生长过程中,根系分泌物促进了土壤微生物生物量碳(MBC)的增加,施N水平显著影响土壤MBC的更新率,而对DOC更新率的影响较小。研究结果发表在Plant and Soil(Ge et al., 2014, DOI: 10.1007/s11104-014-2265-8)。该研究量化了水稻光合碳输入对土壤不同碳库的贡献,解析了光合碳在地下部的动态去向,研究为深入解析稻田碳循环及土壤微生物在光合碳转化中的作用机制提供了重要的理论基础。
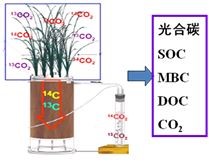
图2 水稻光合碳的输入与在土壤中转化示意图
在稻田土壤微生物固碳(同化大气CO2)功能方面,研究人员利用14C连续标记技术,结合密闭系统培养土壤开展工作(图3),研究表明,无论是80d还是110d的培养期,在光照处理下,农田土壤微生物均具有可观的CO2同化能力,据估算,他们的CO2日同化速率在0.01-0.1gCm?2之间。如果推算到全球陆地生态系统,理想状态下,全球陆地生态系统土壤微生物的年碳同化量在0.3-3.7Pg。然而,遮光处理的土壤,其微生物的碳同化功能被完全抑制了。研究结果发表在Geochimica et Cosmochimica Acta(Ge et al., 2013, 113: 70–78)。同时,研究表明,土壤微生物的光合固碳作用只发生在表层土壤,但表层同化碳可以向下传输,这可能为底层的化能自养微生物提供碳源和电子供体,从而诱导化能自养微生物参与碳同化过程,从而揭示了土壤微生物光能、化能自养固碳的双重协同机制。研究结果发表在Applied Microbiology and Biotechnology(Wu & Ge et al., 2014, 98: 2309–2319)。
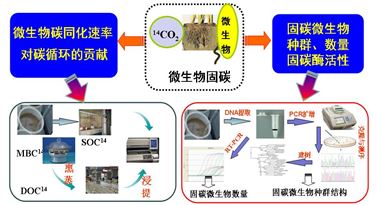
图3 土壤微生物固碳功能(同化大气CO2)及其生物学机制技术框架图
同时,通过克隆文库、T-RFLP及定量PCR等分子生物学技术,对土壤固碳微生物群落组成、结构和数量进行了分析,阐释了稻田土壤微生物固碳的分子生物学机理,明确了功能微生物种群结构(图3)。结果表明,稻田土壤固碳细菌的优势种群可能是红假单胞菌、慢生根瘤与劳尔氏菌菌等,而藻类则以黄澡和硅藻为主,明确了稻田土壤参与CO2光合同化的功能基因(cbbL)及其丰度(0.04~1.3×108 copies g-1),研究结果发表在Applied and Environmental Microbiology(Yuan & Ge et al., 2012, 78: 2328–2336)。同时,依托稻田长期定位试验,研究发现,在田间条件下,稻田土壤也存在相当数量的细菌cbbL基因拷贝数及较高的RubisCO酶活性。根据酶活性估算,年碳同化量在100-450kg/ha之间,这与室内14C-CO2连续标记培养实验得出的碳同化量相当,这为我们估算田间条件下,土壤自养微生物的CO2同化速率提供了可能性,研究结果发表在Applied Microbiology and Biotechnology(Yuan & Ge et al., 2012, 95: 1061–1071)和Biology and Fertility of Soils(Yuan & Ge et al., 2013, 49: 609–616),同时建立了“超声破碎分离提取”土壤固碳关键酶RubisCO活性的提取方法,创建了基于土壤RubisCO活性测定的自然土壤微生物碳同化速率的估算方法(碳同化速率=0.16×RubisCO活性–0.001)。研究结果发表在Pedobiologia(Wu & Ge et al., 2014, 57: 277–284)。因此,该研究揭示了一个以往被忽视的土壤有机碳的重要输入途径,同时改变了土壤微生物在稻田生态系统中仅担负有机质分解、矿化功能的长期认识,亦丰富了微生物的基本功能和在碳循环过程中的作用。

